0x00 序言
21世纪是知识经济时代,药学科学正以前所未有的速度发展
新技术、新方法层出不穷,学科间的交叉、融合、综合发展的趋势更加明显。
国际医药工业现代化水平显著提高,我国新药研究从仿制向创制的战略转移势在必行。
0x01 绪论
一、药物分析的性质、任务和发展
性质:主要研究化学合成药物和化学结构已经明确的天然药物及其制剂的组成、理化性质、真伪鉴别、纯度检查、有效性和安全性以及有效成分含量测定的一门方法学科。
- 药品质量检验
- 药品生产过程中的质量控制
- 贮藏过程中的质量监督控制
- 临床药物分析
- 制定和完善药品质量标准
二、药品质量标准
一、药品质量与质量标准
(一)药品的质量
- 药物的疗效与毒副作用.
- 药物的纯度
(二)药品质量标准及其分类
国家对药品质量及检验方法所作的技术规定。
药品生产、经营、使用、检验和监督管理部门共同遵循的法定依据。
兽药质量标准分类
- 国家标准 兽药典
- 部颁标准 未列入兽药典的标准
- 试行标准 针对新兽药
- 企业标准 企业内控标准
药品质量标佳的主要内容
(一)原料药
- .名称:CADN、INN
- 有机药物结构式
- 分子式及分子质量
- 来源或有机药物的化学名称,活性成分的含量限度规定
- 性状
- 含量测定
- 鉴别
- 制剂
- 检查
- 作用与用途
- 贮藏
(二)制剂
- 名称:CADN、INN
- 来源或含量限度
- 处方
- 制法
- 作用与用途
- 性状
- 用法与用量
- 鉴别
- 规格
- 检查
- 注意
- 含量测定
- 贮藏
三、 药典
一、中国兽药典
- 记载药品质量标准的法典
- 国家监督、管理药品质量法定技术标准
- 具有法律的约束力
\(药典\left\{ \begin{array}{l}一部:化学和生化药品、抗生素、 放射性药品、药用辅料 \\二部:中药材、中药成方制剂(二部)\\三部:生物制品\end{array} \right.\)
\(药典内容\left\{\begin{array}{l} 凡例\left\{\begin{array}{l}解释、使用药典基本原则\\规定正文、附录共性问题\end{array}\right.\\正文\left\{\begin{array}{l}药品质量标准\\制剂质量标准\\生物制品质量标准\end{array}\right.\\附录\left\{\begin{array}{l}制剂通则\\通用检测方法\\指导原则\end{array}\right.\\索引\left\{\begin{array}{l} 中文索引\\英文索引\end{array}\right. \end{array}\right.\)
凡例分类项目
1. 名称:
- 《中国药品通用名称》
- 《国际非专利药品》(International Nonproprietary Names for Pharmaceutical Substances,INN)
- 《有机化学命名原则》,母体的选定应与CA一致:
- 化学结构式按世界卫生组织推荐“药品化学结构式
- 书写指南”书写。
2.检验方法和限度
标准中规定的各种纯度和限度数值以及制剂的重(装)量差异,系包括上限和下限两个数值本身及中间数值,均为有效数字。
原料药的含量(%),除另有注明者外,均按重量计。如规定上限为100%以上时,系指用本药典规定的分析方法测定时可能达到的数值,为药典规定的限度或允许偏差,并非真实含有量;如未规定上限时,系指不超过101.0%。
3、标准品、对照品
- 用途:用于鉴别、检查、含量测定的标准物质。
- 特点:由国务院药品监督管理部门指定单位制备、标定和供应。
- 标准品:用于生物检定、抗生素或生化药品中含量或效价测定;按效价单位(或g)计,以国际标准品标定。
- 对照品:用于结构确切物质(如化学药)分析。按干燥品(或无水物)进行计算后使用。
4.精确度 药典视定取样量的准确度和狱验精密度
- 试验中供试品与试药等“称重”或“量取”的量,以阿拉伯数字表示,精确度根据数值的有效数位来确定。
- 精密称定:称取重量准确至所取重量千分之一
- 称定:称取重量应准确至所取重量的百分之一
- 取用量为“约”:所取量不得超过规定量士10%
正文编排和内容
- 正文收载药品或制剂的质量标准,按中文药品名称笔画顺序编排,单方制剂排在原料药后面;生物制品集中排列。
- 每一品种项含:
- 品名(包括中文名,汉语拼音名与英文名)
- 有机药物的结构式;
- 分子式与分子量;
- 来源或有机药物的化学名称;
- 含量或效价规定;
- 处方;
- 制法;
- 性状;
- 鉴别;
- 检查;
- 含量或效价测定;
- 类别;
- 规格;
- 贮藏;
- 制剂
标准针对药品质量控制的真伪、纯度和品质优良度
现行《美国药典》:USP(29)-NF(24),于2006年1月生效。美国药典每年1版,并有3个增补版。光盘版(CD-R0M)与印刷版同时发行。
《英国药典》,BP
- 该药典由三卷本组成。其中两卷为英国药典、一卷为英国兽药典(兽医药品部分)。
- 各条目均以药品名称字母顺序排列,内容包括药品性质、制法、血产品、免疫产品、电磁药品制法及外科材料等部分。
- 英国药典书后附有全部内容关键词索引。
《日本药局方》,第十四改正版JP(14)
- 凡例、正文、附录和索引等内容组成
- 一部为化学药品、抗生素、放射性药品及制剂
- 二部收载生药、生物制品、调剂用附加剂等
- 索引:日本名、英文名和拉丁名索引三种。
- 质量标准主要内容:鉴别、检查、含量测定。
三、*药品质量管理规范
质量管理规范
- GCP 药品临床试验管理规范(良好药品临床试验规范)
- GMP 药品生产质量管理规范
- GSP 药品经营质量管理规范(良好药品供应规范)
- GLP 药品非临床研究质量管理规范(良好药物实验研究规范)
- GAP 中药材生产质量管理规范
药品检验基本程序:
\(\begin{matrix}取样:科学、真实、代表 \\ \Downarrow \\ 检验:依据质量标准 \\\Downarrow\\记录:真实、完整、简明、具体 \\\Downarrow\\报告:结论明确\end{matrix}\)
四、学习的要求与方法
0x02 药物的鉴别
- 概述
- 鉴别试验的项目
- 鉴别试验的方法
- 鉴别试验的条件
鉴别试验的项目
一、性状鉴别
(一)外观、臭、味
通用说法:本品为..(颜色).…(状态);…(臭);.(味)
(二)溶解度
极易溶解、易溶、溶解、略溶、微溶、极微溶解、几乎不溶或不溶
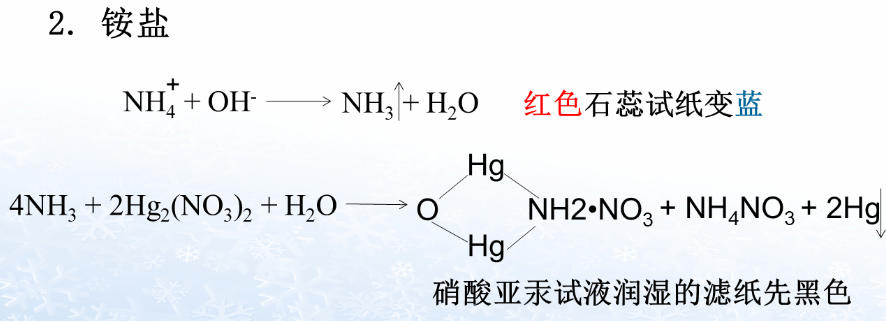
二、一般鉴别试验
通过化学反应进行试验来证明药品中含有
某一离子或基团。
(一)有机氟化物
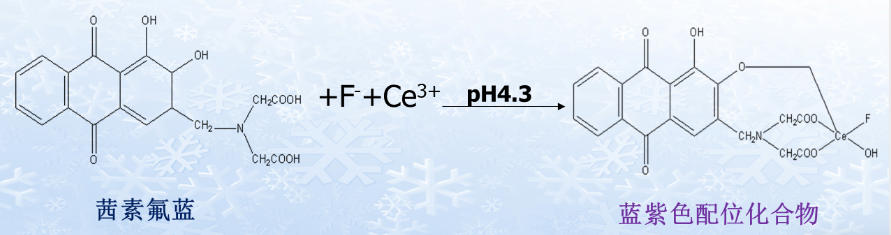
(二)有机酸盐
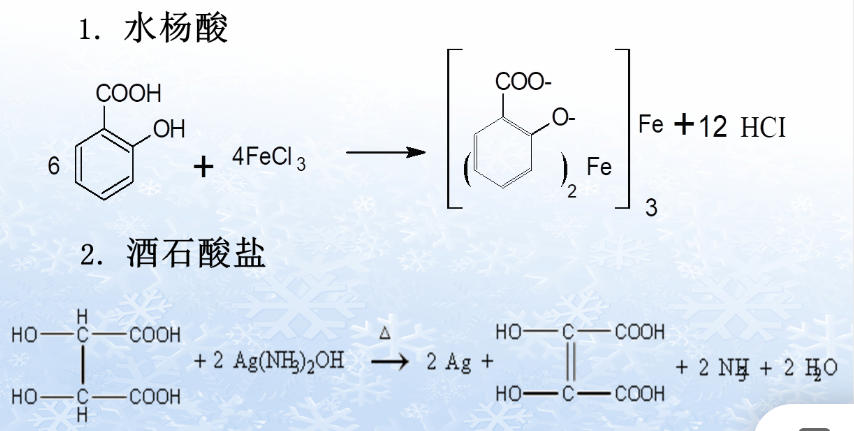
(三)芳香第一胺类
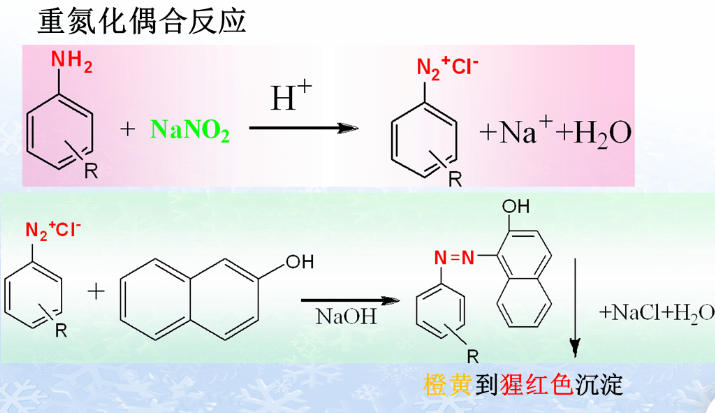
(六)无机酸根
1. 氯化物 2. 硫酸盐
三、专属鉴别试验
- 化学鉴别法
- 光谱鉴别法
- 色谱鉴别法
- 其它鉴别法
一、化学鉴别法
- 颜色改变
- 沉淀生成
- 荧光出现
- 气体产生
- 衍生物熔点
1、干法
- 将供试品加适当试剂在规定的温度条件下(一般是高温)进行试验,观测此时所发生的特异现象。
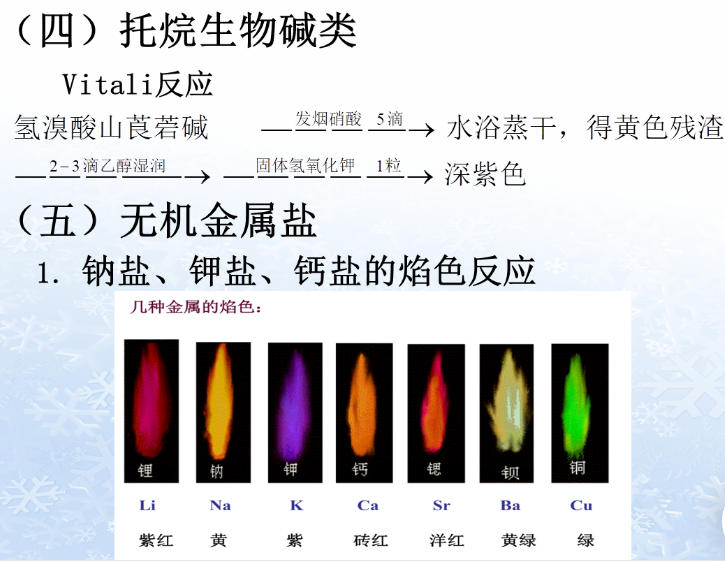
- (1)焰色试验:常用干法。利用某些元素所具有的特异焰色,可鉴别它们为哪一类盐类药物。
- 方法:取铂丝,用盐酸湿润后,蘸取供试品,在无色火焰中燃烧,使火焰显出特殊的颜色。
- (2)加热分解:在适当的温度条件下,加热使供
试品分解,生成有特殊气味的气体。
2、湿法
- 系指将供试品和试剂在适当的溶剂中,于一定条件下进行反应,发生易于观测的化学变化,如颜色、沉淀、气体、荧光等。
- (1)显色反应鉴别法
系指供试品溶液中加入适当的试剂溶液,在一定条件下进行反应,生成易于观测的有色产物。在鉴别试验中最为常用的反应类型有:
- 三氯化铁呈色反应——酚羟基或水解后产生酚羟基;
- 异羟肟酸铁反应——多为芳酸及其酯类、酰胺类;
- 茚三酮呈色反应——脂肪氨基;
- 重氮化偶合显色反应——芳伯氨基或能产生芳伯氨基;
- 氧化还原显色反应及其它颜色反应。
- (2)沉淀生成反应鉴别法
常用的这类反应有:
- 与重金属离子的沉淀反应一在一定条件下,药物和重金属离子反应,生成不同形式的沉淀
- 与硫氰化铬铵(雷氏盐)的沉淀反应—多为
生物碱及其盐,具有芳香环的有机碱及其盐; - 其它沉淀反应。
- (3)荧光反应鉴别法
常用的荧光发射形式有以下类型:
- 药物本身可在可见光下发射荧光;
- 药物溶液加硫酸使呈酸性后,在可见光下发射荧光;
- 药物和溴反应后,于可见光下发射出荧光;
- 药物和间苯二酚反应后,发射出荧光及药物经
- 其它反应后,发射荧光。
- (4)气体生成反应鉴别法
- 大多数的胺(铵)类药物、酰脲类药物以及某些酰胺类药物,可经强碱处理后,加热,产生氨(胺)气;
- 化学结构中含硫的药物,可经强酸处理后,加热,发生硫化氢气体
- 含碘有机药物经直火加热,可生成紫色碘蒸气;含醋酸酯和乙酰胺类药物,经硫酸水解后,加乙醇可产生乙酸乙酯的香味。
二、光谱鉴别法
(一)紫外-可见分光广度法(UV-Vis)
- 测定最大吸收波长,或同时测定最小吸收波长
- 规定一定浓度的供试液在最大吸收波长处的吸光度
- 规定吸收波长和吸收系数法
- 规定吸收波长和吸收度比值法
- .经化学处理后,测定其反应产物的吸收光谱特性
杂质检查
- 概述
- 一般杂质检查
- 特殊杂质检查
概述
药物的纯度要求
有效性:
针对某些药效进行检查的项目
如AI(OH)3的制酸力,反映主要质量;
明胶的凝冻度,控制物理性能;
利福平的结晶度,影响生物利用度
均一性:
含量均一性
如“含量均匀度”试验
安全性:进行异常毒性、热原、降压物质和无菌等项目
纯度要求:对杂质限量进行检查
杂质来源与种类:
1.生产过程中产生
酸度:水解试剂带入
乙醇中不溶物:水解中间体(糊精)
SO32-产品用H2S03漂白
可溶性淀粉:水解不完全
在药物生产过程中引入杂质的途径为:
- 原料不纯或部分未反应完全的原料造成
- 合成过程中产生的中间体或副产物分离不净造成
- 需加入的各种试剂产生吸附,共沉淀生成混晶等造成
- 所用金属器皿及装置等引入杂质
- 由于操作不妥,日光曝晒而使产品发生分解引入的杂质
2.贮藏过程中产生
外界条件影响:日光、空气、温度、湿度、微生物等引起药物产生
例如:麻醉乙醚\(\ce{->}\)醛及有毒的过氧化物
水解、氧化、分解、异构化、晶形转变、聚合、潮解和发霉等
易发生水解反应的结构:酯、内酯、酰胺、卤代烃、苷类等
易发生氧化反应的结构:醚、醛、酚羟基、巯基、亚硝基、双键等
杂质的种类
(1)一般杂质:
在多种药物中普遍存在的杂质。
(C1- S042- Pb As Fe)
有害杂质(Pb As
信号杂质(C1- S042-):考察生产工艺,反映药物的纯度水平
(2)特殊杂质:
指某一个或某一类药物在生产和贮藏过程中开入的杂质。
3、杂质的限量检查limit test)
杂质的限量:药物中所含杂质的最大允许量。
限量表示(g/g):百分之几(%)/百万分之几(10-6)
限量检查:
检查所含杂质是否超过杂质限量的规定,通常不要求测定其准确含量。
1.对照法:
限量检查法(Limit Test)
特点:不需知道杂质的准确含量,取一定量(CxV))与被检杂质相同的纯品或对照品
配成对照品溶液,与一定量(S)药物供试溶液在相同条件下处理后,比较反应结果,以确定杂质含量是否超过规定
2.灵敏度法
系指在供试品溶液中加入试剂,在一定反应条件下,不得有正反应出现。
特点:不需对照品
一般杂质检查
一
二 重金属检查
- 硫代乙酰胺法
Pb2+ + 醋酸盐缓冲液PH3.5 + 硫代乙酰胺CH3CSNH2